Tutti i farmaci ad attività antidepressiva hanno un tempo di latenza di giorni o settimane prima di manifestare l’effetto clinico nel paziente trattato; è perciò lecito da parte del medico studiare l’attuazione di tecniche di potenziamento farmacologico sia all’inizio della terapia, per accorciare il periodo di latenza, che di fronte ad una risposta solo parziale.
Già dai primi anni ottanta sono state messe a punto varie strategie. La letteratura riporta l’utilizzo di tecniche di potenziamento farmacologico mediante l’associazione di farmaci antidepressivi o di un antidepressivo con sali di litio o con ormoni tiroidei. Non è possibile stabilire una percentuale di risposta date le marcate differenze metodologiche fra i vari studi, ma dagli studi confrontabili si può estrapolare un range di risposta variabile dal 50% al 65% per quanto riguarda l’associazione con sali di litio, mentre il range di risposta si aggira su una percentuale pari al 20-30% dei pazienti per l’associazione di antidepressivi triciclici o inibitori selettivi del reuptake della serotonina con gli ormoni tiroidei.
Recentemente, è stata proposta la combinazione di un composto classificato come b-bloccante, quale il pindololo, ad un antidepressivo serotoninergico. Il rationale scientifico di questa associazione si basa su studi elettrofisiologici effettuati sull’animale da esperimento che hanno evidenziato che la somministrazione acuta di SSRI riduce l’attività di scarica dei neuroni serotoninergici e che dopo trattamento cronico tale attività viene ripristinata. Una spiegazione di questo processo potrebbe essere la desensibilizzazione degli autorecettori somatodendritici 5-HT1A, presenti sui neuroni serotoninergici. Gli autorecettori 5-HT1A controllano il rilascio di serotonina nella corteccia mediante un’azione inibitoria sul neurone serotoninergico, perciò all’inizio di un trattamento con SSRI la stimolazione degli autorecettori impedisce l’aumento di serotonina nello spazio sinaptico. Solo il trattamento prolungato per due settimane del farmaco inibitore del reuptake aumenta le concentrazioni extracellulari di serotonina nella corteccia frontale per l’avvenuta desensibilizzazione degli autorecettori inibitori.
In breve, potremmo così schematizzare quanto segue alla somministrazione a breve termine di un SSRI: a) blocco della ricaptazione della serotonina a livello dei nuclei del rafe e un conseguente aumento delle concentrazioni di serotonina in questa sede; b) attivazione degli autorecettori somatodendritici 5-HT1A presenti sul corpo cellulare del neurone serotoninergico; c) riduzione del firing neuronale con diminuzione del rilascio di serotonina nei terminali sinaptici. Dopo somministrazione prolungata di un SSRI: d) desensibilizzazione degli autorecettori somatodendritici 5-HT1A; e) aumento del rilascio di serotonina dai terminali sinaptici, ad es. corteccia; f) aumento delle concentrazioni di serotonina nelle aree terminali, con conseguente attivazione dei recettori post-sinaptici.
E’ altamente suggestivo della validità di questa ipotesi che il tempo di latenza dell’azione clinica antidepressiva di un SSRI corrisponda al periodo necessario all’aumento della serotonina nella corteccia. In base a queste osservazioni è stato proposto di associare all’inizio di un trattamento con SSRI un antagonista dei recettori somatodendritici 5HT1A, per ottenere l’annullamento dell’azione inibitoria sul rilascio di serotonina e, quindi, una accelerazione e/o un aumento dell’effetto antidepressivo. L’efficacia dell’associazione fra pindololo – composto che, benchè non selettivamente, blocca gli autorecettori 5-HT1A – e diversi SSRI (paroxetina, fluoxetina e fluvoxamina) è stata dimostrata in vari studi clinici condotti sia in aperto che in cieco. In particolare, in uno studio in doppio cieco, condotto da un gruppo spagnolo in un ampio campione di pazienti affetti da depressione maggiore, e’ stata dimostrata l’efficacia dell’associazione fluoxetina e pindololo nell’accelerare la risposta clinica in confronto ai tempi di risposta alla monosomministrazione di fluoxetina. In un altro ampio studio in doppio cieco, condotto nel Dipartimento di Scienze Neuropsichiche dell’Ospedale S. Raffaele di Milano, e’ stato evidenziato che associando il pindololo alla paroxetina all’inizio del trattamento si ottiene una riduzione significativa dei tempi della risposta clinica e che potraendo la somministrazione per tutta la durata dello studio si ottiene un aumento della percentuale di pazienti che rispondono al trattamento (vedi tabella 1). Per poter attribuire con un certo margine di certezza l’effetto di potenziamento della risposta clinica all’azione di blocco dei 5-HT1A e non dei __da parte del pindololo, nello stesso studio un gruppo di pazienti ha assunto la combinazione paroxetina e metoprololo (un _-bloccante senza attività sui 5-HT1A). Non si è evidenziata una riduzione dei tempi di risposta, nè un aumento del numero di pazienti che ha risposto al trattamento.
 |
|
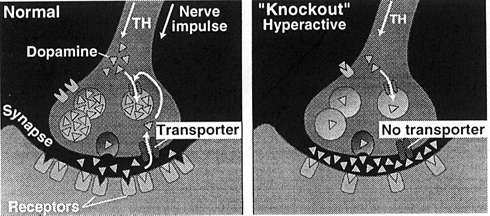
Modificazioni adattative nella trasmissione dopaminergica nei topi DAT. |
Il vantaggio di questa strategia appare enorme se, ad esempio, si considerano pazienti con depressione delirante, dove la latenza di risposta risulta essere un fattore di grande sofferenza per il paziente e lo rende facilmente a rischio di autospensioni della terapia farmacologica di cui non vede alcun beneficio. Pazienti ospedalizzati, con diagnosi di depressione maggiore con manifestazioni psicotiche secondo i criteri del DSM-IV, sono stati trattati in doppio cieco con fluvoxamina associata a placebo o a pindololo. Alla fine dello studio, durato 6 settimane, la percentuale totale di responders era sovrapponibile per entrambi i gruppi di trattamento e pari all’80 % circa, e, dato molto interessante e di grande rilievo clinico, nella terza e nella quarta settimana di trattamento è stata osservata una significativa maggior percentuale di responders nel gruppo trattato con fluvoxamina e pindololo.
Esistono anche tecniche non farmacologiche per il potenziamento degli effetti dei farmaci antidepressivi. La più potente tra queste è la deprivazione di sonno, che si è ampiamente diffusa nella psichiatria tedesca e, in anni recenti, italiana e statunitense. La letterature internazionale riporta che una notte di deprivazione totale di sonno produce un rapido e marcato miglioramento dei sintomi depressivi in pazienti affetti da disturbi dell’umore. Non di rado l’entità dell’effetto è tale da comportare il brusco ritorno alla condizione di normotimia, il mattino successivo alla deprivazione, di pazienti con quadri depressivi gravi e protratti. L’effetto è presente in circa il 60% dei pazienti ed ha quindi una percentuale di risposta paragonabile a molti trattamenti farmacologici, col vantaggio però di essere molto più rapido e sostanzialmente privo di effetti collaterali. L’utilizzo clinico su larga scala è stato limitato dalla elevata percentuale di ricadute nei giorni immediatamente successivi al completamento del ciclo di deprivazione di sonno: l’80% circa dei pazienti responder, se non trattati farmacologicamente, presenta una ricaduta depressiva dopo una notte di sonno.
Per ovviare alla transitorietà dell’effetto antidepressivo, sono state elaborate varie strategie. Alcuni gruppi di ricerca hanno proposto la ripetizione di più cicli di deprivazione, ma senza ottenere un sostanziale prolungarsi della risposta. Altri hanno proposto la deprivazione selettiva di sonno REM (effetto comune anche a tutti i farmaci dotati di attività antidepressiva) o manipolazioni del ritmo sonno-veglia (ad esempio, l’anticipo della fase di sonno con risveglio definitivo nella seconda parte della notte). Altri ancora hanno associato la deprivazione di sonno a trattamenti farmacologici, che impediscono la ricaduta depressiva dopo il ripristino del sonno: sali di litio, amitriptilina, nortriptilina, clomipramina. La rapidità dei miglioramenti indotti dalla deprivazione di sonno consente così di ridurre il periodo di latenza dell’azione antidepressiva comune ai farmaci che, a loro volta, prolungano e mantengono l’effetto della deprivazione di sonno.
Il meccanismo d’azione della deprivazione di sonno è da considerarsi tuttora ipotetico. L’osservazione clinica di migliori effetti antidepressivi della deprivazione di sonno nei pazienti bipolari e l’osservazione fenomenologica del presentarsi spontaneo di notti di deprivazione totale di sonno prima dell’inizio delle fasi maniacali, suggeriscono che gli effetti clinici della deprivazione di sonno siano legati alla stimolazione dei medesimi meccanismi che sono all’origine della mania. Gli studi neurochimici sull’uomo e sull’animale mostrano che la deprivazione di sonno induce un marcato aumento nell’attività dei sistemi monoaminergici cerebrali, e che tali alterazioni si correlano alla risposta clinica (come documentato in studi classici sulla composizione del liquor cefalo-rachidiano e in più recenti studi con tomografia a emissione di fotoni singoli); è probabile che l’effetto clinico euforizzante e antidepressivo della deprivazione di sonno sia legato all’aumentata attività dei sistemi dopaminergico e serotoninergico. Il meccanismo è tuttavia da considerarsi molto complesso per la presenza di interazioni tra i vari sistemi trasmettitoriali cerebrali stimolati dalla deprivazione di sonno.
In considerazione di un effetto euforizzante, presso il nostro dipartimento sono stati condotti studi in cui abbiamo applicato la deprivazione di sonno a diversi gruppi di pazienti affetti da depressione maggiore. Un primo studio ha evidenziato una netta differenza nella risposta a questa terapia nei pazienti con depressione unipolare e bipolare: i pazienti bipolari rispondono a tale trattamento in una percentuale significativamente piu’ alta, così come è maggiore la percentuale di pazienti che mantengono l’effetto antidepressivo senza necessità di trattamenti ulteriori. Questo dato dovrebbe essere tenuto in considerazione nella valutazione degli studi in cui la deprivazione di sonno è stata applicata a gruppi di pazienti depressi con diagnosi dello spettro affettivo in senso lato. Una volta selezionato il gruppo di pazienti con la potenzialità maggiore di risposta alla deprivazione di sonno (pazienti affetti da disturbo bipolare in fase depressiva) sono stati condotti studi di combinazione tra deprivazione di sonno e terapie farmacologiche per stabilire delle strategie atte al sostenimento della risposta ottenuta mediante la sola deprivazione di sonno.
Si è così osservato che la interazione positiva classicamente descritta tra deprivazione di sonno e antidepressivi triciclici è valida anche per gli SSRIs: tre notti di deprivazione totale di sonno (alternate a notti di recupero) durante trattamento con fluoxetina sono in grado di accelerare marcatamente la risposta a tale trattamento, pur senza modificare la percentuale totale di risposta. L’associazione di deprivazione di sonno e farmaci ad azione sul sistema dopaminergico ha portato invece a risultati di dubbia interpretazione: in pazienti già sottoposti a trattamento con amineptina la deprivazione di sonno sembra perdere gran parte del suo effetto clinico (suggerendo la comparsa di fenomeni di down-regulation recettoriale), mentre il trattamento con amineptina iniziato in concomitanza con l’inizio del trattamento con deprivazione di sonno ne migliora l’effetto immediato sui livelli percepiti di umore (misurati con scale autosomministrate) senza portare a duraturi effetti clinici oggettivamente misurati. L’interazione positiva tra farmaci ad azione sul sistema serotoninergico e la deprivazione di sonno è confermata dallo studio dell’associazione di questa con pindololo: tale farmaco potenzia l’effetto della deprivazione di sonno sia nell’immediato, sia sostenendone l’effetto nel tempo, suggerendo in tal modo che l’effetto clinico della deprivazione di sonno è in larga parte da attribuirsi a potenziamento dell’attività serotoninergica centrale. A questo proposito è da osservare che il sistema serotoninergico raggiunge i suoi massimi livelli di attività durante l’arousal, e i minimi durante il sonno, e che studi preclinici sull’animale da esperimento (ratto, gatto, coniglio) mostrano che la deprivazione di sonno aumenta il firing nei neuroni serotoninergici del nucleo dorsale del rafe, aumenta il turnover della serotonina, aumenta la risposta comportamentale a precursori della serotonina, e decresce la sensibilità dei recettori 5-HT1A.
Infine, l’effetto di cicli ripetuti di deprivazione totale di sonno è stato recentemente studiato in pazienti bipolari depressi sottoposti a trattamento a lungo termine con sali di litio. Tale interazione è particolarmente rilevante da un punto di vista clinico, perchè i sali di litio sono da considerarsi il trattamento farmacologico di elezione per la terapia del disturbo bipolare. Si è osservato che i sali di litio (assunti da almeno un anno) sono in grado, da soli, di sostenere l’effetto clinico della deprivazione di sonno, portando alla remissione completa della sintomatologia depressiva nel 70% dei pazienti trattati. Data la complessità degli effetti neurochimici dei sali di litio e della deprivazione di sonno, il meccanismo biologico alla base di tale interazione positiva non è noto.
Nonostante l’incertezza sul preciso meccanismo d’azione, la possibilità di potenziamento e accelerazione dell’azione farmacologica antidepressiva con queste tecniche (da considerarsi quasi completamente scevre di effetti collaterali) è di crescente rilevanza clinica.
![]()







0 commenti