Un gruppo interdisciplinare e inter-universitario statunitense (Harvard, Columbia, New York), con due pubblicazioni, una su Psychoneuroendocrinology [1] e l’altra su Journal of Clinical Endocrinology and Metabolism [2] chiarisce, per la prima volta, con evidenze strumentali, una relazione da anni segnalata dalla clinica e dalla ricerca PNEI: il rapporto tra stress emozionale e insorgenza del diabete.
Obesità e diabete: un legame che non spiega tutto
Una relazione che è stata oscurata dalla visione tradizionale che ha concentrato l’attenzione sul rapporto tra alimentazione (con conseguente sovrappeso, obesità viscerale) e diabete. Relazione indubbiamente vera e documentata da numerosi studi sia sperimentali che osservazionali. Tuttavia, ci sono anomalie nel paradigma della genesi alimentare del diabete. Innanzitutto, per fortuna, molti obesi non sono diabetici. Inoltre si può essere diabetici senza essere obesi. Quindi, oltre agli eccessi alimentari e alla sedentarietà, che indubitabilmente favoriscono il diabete, ci devono essere altri fattori che contribuiscono all’insorgenza della malattia.
Da questo ragionamento è partita l’indagine dei ricercatori statunitensi, che hanno utilizzato una sofisticata tecnologia (18F-FDG-PET-CT in sigla, che combina una Tomografia a emissione di positroni- che utilizza il fluorodeossiglucosio18– e una Tomografia computerizzata) che misura contemporaneamente l’attività del cervello e il volume del grasso cosiddetto viscerale, quello della pancia.
L’area cerebrale monitorata è il circuito della salienza (salience network), un insieme di strutture cerebrali interconnesse coinvolte in funzioni complesse come cognizione ed emozione, che ha nell’amigdala una componente fondamentale. Da precedenti ricerche si sa che l’amigdala è la struttura chiave dell’allerta[3] che è alla base dell’ansia. Il circuito della salienza, come dice il nome, entra in azione ogni volta che la mente percepisce uno stimolo significativo, saliente, per l’appunto, che disattiva la dominanza del circuito cerebrale centrato sul nostro interno (il cosiddetto default mode network) e favorisce lo spostamento sul circuito esecutivo (executive network). L’amigdala è il perno dello switch, poiché non solo attiva i circuiti frontali esecutivi, ma attiva anche il sistema dello stress come mostra la Fig. 1
La valutazione della sua attività metabolica, possibile con la PET che utilizza il radionuclide F18, consente di avere una misura biologica dello stato emozionale del soggetto.
IL SISTEMA DELLO STRESS
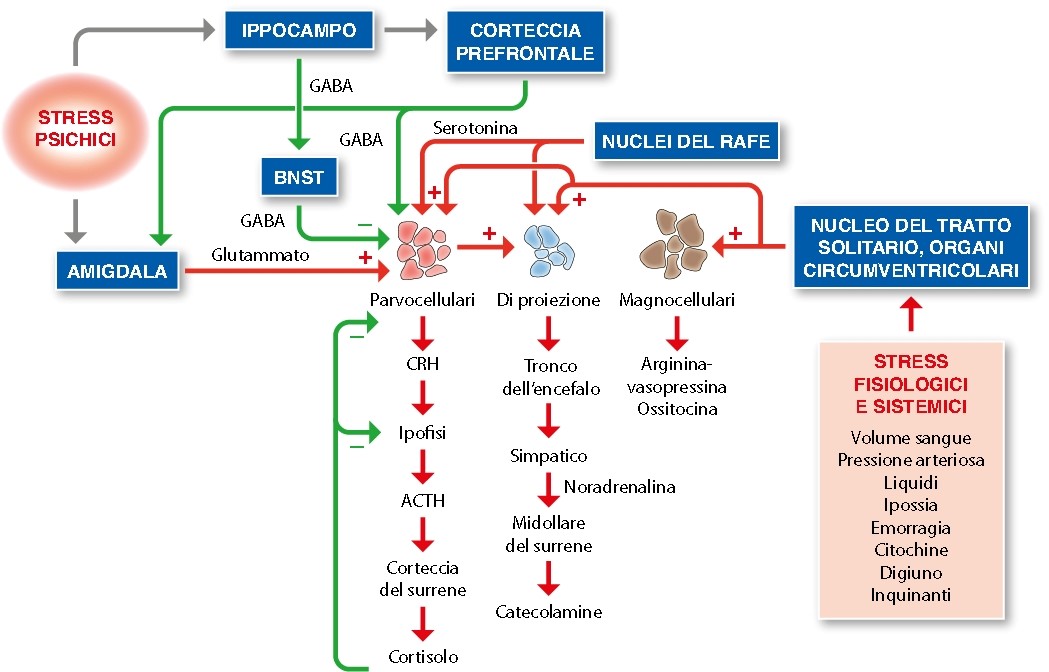
Fig. 1 Gli stressor psichici vengono recepiti, tramite la corteccia prefrontale e anche direttamente, dall’amigdala che attiva il sistema dello stress. Gli stressor biologici e ambientali seguono invece la via del tronco dell’encefalo (Nucleo del tratto solitario) e delle strutture cerebrali attorno ai ventricoli (Organi circumventricolari)
La figura è ripresa da: Bottaccioli F, Bottaccioli AG (2017) Psiconeuroendocrinoimmunologia e scienza della cura integrata. Il Manuale, Edra, Milano, p. 136. Per gentile concessione dell’Editore
Legenda: BNST Nucleo del letto della stria terminale; GABA Acido gamma amino butirrico; CRH Ormone che rilascia la corticotropina; ACTH Ormone adrenocorticotropico (o corticotropina)
I ricercatori hanno incrociato i dati della PET cerebrale focalizzati sull’amigdala di persone senza diabete con la comparsa della malattia, nel corso dei successivi 5 anni dal momento della PET, riscontrando che le persone che avevano il metabolismo dell’amigdala più elevato avevano anche una maggiore incidenza del diabete. In particolare, l’iperattività dell’amigdala correla con un aumento del rischio di diabete fino a 5 volte superiore rispetto al gruppo con una amigdala meno attiva.
L’altro dato di grande interesse è che questa correlazione tra iperattività dell’amigdala e comparsa del diabete è indipendente dalle dimensioni del grasso viscerale. Più precisamente, come mostra l’immagine tratta dallo studio (vedi Fig. 2), a parità di grasso viscerale, è l’iperattività dell’amigdala che determina l’insorgenza del diabete.

Fig. 2 L’individuo A mostra una bassa attività dell’amigdala, mentre il B un’alta attività. Entrambi mostrano lo stesso alto livello di adiposità viscerale, ma il diabete interverrà solo nell’individuo B, a causa della sua iperattività emozionale documentata dalla iperattività dell’amigdala.
Fonte: Osborne MT et al (2019) citato in nota 1.
Ovviamente, se accanto alla iperattività dell’amigdala c’è anche un’espansione del grasso viscerale, il rischio di diabete aumenta.
In entrambe le condizioni infatti aumenta l’infiammazione: dal grasso, soprattutto addominale e attorno ai visceri, vengono rilasciate adipochine infiammatorie, mentre l’iperattivazione del sistema dello stress, tramite l’amigdala, produce infiammazione in ragione dell’eccesso di cortisolo che causa resistenza nelle cellule immunitarie e anche a causa della mobilizzazione delle cellule immunitarie dal midollo osseo. Quest’ultimo fenomeno è stato documentato nel lavoro citato in nota 2: l’attività dell’amigdala è associata con l’attività del midollo osseo, che, a sua volta, è associata con il grasso viscerale. Questi fenomeni sono alla base della insulino-resistenza che causa iperglicemia e diabete.
Queste ricerche indicano i meccanismi biologici che possono spiegare la relazione tra stress emozionale, depressione, ansia e insorgenza del diabete, rafforzando un concetto più volte espresso dalla ricerca PNEI sulla bidirezionalità del loro rapporto: la depressione favorisce l’insorgere del diabete e, a sua volta, il diabete favorisce l’insorgere della depressione.
Gli studi al riguardo sono numerosi: per una loro rassegna rinvio al nostro Manuale PNEI[4] dove è possibile trovare anche indicazioni di prevenzione e cura integrata del diabete e di altri disturbi metabolici
PUBBLICATO SU PNEI NEWS N.2/2019.
Pnei News e Pnei Review sono le riviste scientifiche della Società Italiana di Psiconeuroendocrinoimmunologia, fondate e dirette da Francesco Bottaccioli. Per info: www.sipnei.it
![]()








0 commenti